Mejorar el acceso a medicamentos huérfanos, objetivo de la Estrategia Farmacéutica Europea
El pasado mes de noviembre el Parlamento Europeo daba el visto bueno a la Estrategia Farmacéutica Europea (EFE), un documento guía que va a servir para transformar poco a poco, y a lo largo de la próxima década, los procesos que regulan la I+D farmacéutica, así como la aprobación y distribución de medicamentos, entre otros aspectos.
El texto aprobado, coordinado por la eurodiputada española y exministra de Sanidad, Dolors Montserrat, marca varias prioridades que procuran poner al paciente en el centro del sistema. Entre ellas está el fomento de la I+D+i en necesidades no cubiertas, como las de los pacientes con enfermedades poco frecuentes.
“El 95% de las siete mil enfermedades raras que existen en el mundo todavía no tienen ninguna opción de tratamiento. Más de 30 millones de pacientes nos piden una respuesta”, comentaba Montserrat en la presentación de la estrategia.
Hay que recordar que en Europa se consideran poco frecuentes aquellas dolencias cuya prevalencia está por debajo de cinco de cada diez mil habitantes. En España son cerca de tres millones las personas afectadas.
Alineadas con esta idea, en la EFE se encuentran otras prioridades, como la necesidad de mejorar el acceso a tratamientos desde el punto de vista del abastecimiento: según la Federación Española de Enfermedades Raras (Feder), seis de cada diez medicamentos huérfanos (es decir, aquellos dirigidos a tratar estas patologías) que se aprueban desde la Agencia Europea del Medicamento (EMA) no llegan a comercializarse en España.
Los que se consiguen poner en nuestro mercado tardan de media 523 desde la autorización por parte de la EMA hasta la resolución de financiación en España, indican fuentes de Farmaindustria.
Por eso, la EFE busca además la reducción de esos procesos burocráticos para acelerar la salida al mercado de las terapias, siempre y cuando se puedan mantener estándares rigurosos de seguridad, calidad y eficacia. Una noticia que ha supuesto un soplo de aire fresco para los pacientes que padecen este tipo de dolencias y trastornos, que han visto mermar tanto su calidad de vida como sus esperanzas por culpa de la pandemia.
La covid-19 provocó un desequilibrio en los sistemas sanitarios que aún hoy sigue incidiendo negativamente en una menor posibilidad de cuidados y en el infradiagnóstico, como ha venido denunciando Feder en los últimos meses.
Al mismo tiempo, los niveles de investigación han caído notablemente. “Hay proyectos que se pararon porque los laboratorios estuvieron clausurados en los momentos de confinamiento. A todo ello se añaden las bajas de personal, mucho más frecuentes en estos dos años, y el cierre de empresas dedicadas a la investigación”, comenta Eva Bermejo, directora del Instituto de Investigación de Enfermedades Raras (IIER), dependiente del Instituto de Salud Carlos III (ISCIII).
Aunque añade que “la situación actual nos permite ya afrontar una recuperación de la actividad”.
En Europa se consideran poco frecuentes aquellas dolencias cuya prevalencia está por debajo de 5 por cada 10.000 habitantes. En España son cerca de 3 millones las personas afectadas.
En esa recuperación va a ser determinante la colaboración público-privada, trabajando de forma triangular con las asociaciones de pacientes, cada vez más informados y empoderados.
“Es una relación que existe desde hace mucho y que ha de manejarse con cautela, ya que estamos hablando de recursos públicos que han de ir focalizados al bien común”, recuerda Bermejo.
Desde su punto de vista, es muy importante que los pacientes estén cerca para que trasladen a los investigadores y a la industria sus principales necesidades a cubrir. “En este sentido, no podemos desconfiar de las empresas farmacéuticas, hay que tener en cuenta que siempre van a querer que su trabajo sea útil al paciente para obtener el máximo rendimiento de las elevadas inversiones que realizan”, añade.
De las enfermedades raras a la covid-19 y viceversa
Un buen ejemplo para plasmar esta idea lo encontramos en las vacunas contra la covid-19: muchas personas han desconfiado (y algunos aún hoy lo siguen haciendo) de la eficacia de estos fármacos por la velocidad a la que se pusieron en el mercado. (Vid. La eficacia medible de las vacunas).
“Muchos no han sido conscientes de todo el trabajo subyacente que se había realizado ya tiempo atrás en el campo del ARN mensajero (ARNm), mucho antes de que llegara la pandemia. Todo esto se ha convertido en una oportunidad para darle una aplicación práctica a unas investigaciones de largo recorrido y, sin duda, ha sido una decisión acertada”, comenta Bermejo.
Esta técnica ya se había utilizado previamente para tratar algunas enfermedades poco frecuentes. Con ella se puede aportar a las células una especie de ‘libro de instrucciones’ para elaborar proteínas que faltan o que se producen de manera anómala.
“En muchos casos puede ayudar a generar la proteína correcta y, de esta manera, encontrar la manera de corregir la enfermedad. Nos está abriendo un horizonte amplio y estoy segura de que, gracias a ella, vamos a lograr grandes avances en poco tiempo”, asegura la responsable del IIER.
Eva Bermejo, directora del Instituto de Investigación de Enfermedades Raras (IIER), dependiente del Instituto de Salud Carlos III (ISCIII).
En general, todos los conocimientos que se van generando en los procesos de I+D farmacéutico suelen aprovecharse en otras investigaciones y terminan agilizando la aparición de novedades, sobre todo en el campo del reposicionamiento. Es decir, en la búsqueda de nuevas aplicaciones e indicaciones para medicamentos que ya se han demostrado que son seguros.
“Si sabes que un tratamiento ya existente actúa sobre una vía metabólica, pero no tiene indicación para una enfermedad poco frecuente que se ve afectada por esa misma vía metabólica, puedes empezar a hacer ensayos clínicos aprovechando todo el trabajo que se ha hecho previamente para sacar adelante ese fármaco”, explica Bermejo.
Proyecto Fineerr
Otra iniciativa que ha surgido en los últimos meses para analizar la situación de las dolencias poco frecuentes en nuestro país es el proyecto Fineerr, que acaba de hacer público un estudio en el que han participado más de cuarenta expertos en la materia.
Reflexión Estratégica sobre financiación y acceso a las terapias dirigidas a enfermedades raras en España plantea algunas medidas que buscan reducir las brechas existentes, aumentar la equidad en el acceso a las terapias disponibles e introducir estrategias coherentes, eficientes y sostenibles a largo plazo.
El documento, que ha sido elaborado por la Fundación Weber con el apoyo de Roche, recomienda entre otros aspectos fomentar el empoderamiento del paciente para que participe en los procesos de toma de decisión.
“Es fundamental para garantizar su integración como parte implicada y enriquecer las perspectivas, aportar credibilidad y potenciar la transparencia de las decisiones”, reza el texto.
En este sentido, también aboga por mejorar la comunicación entre el paciente y el profesional sanitario, conseguir que sea bidireccional, procurando que el primero comprenda mejor la patología que sufre y las opciones terapéuticas con las que cuenta, así como las fórmulas de atención sanitaria que va a poder utilizar.
De hecho, el informe recomienda aportarles una atención integral desde los Centros, Servicios y Unidades de Referencia del Sistema Nacional de Salud (CSUR), que ya son una parte fundamental del manejo asistencial de muchos pacientes con enfermedades raras.
“Además de mejorar su financiación, se debería avanzar en una mayor incorporación de estos centros en las redes europeas para aprovechar los conocimientos generados y favorecer un mejor tratamiento”, indica el estudio.
En cuanto al ámbito de la I+D, se invita a potenciar destinando más partidas económicas con posibles incentivos fiscales desde las primeras fases de investigación.
“Se deben además disminuir las barreras administrativas y legales de los ensayos clínicos, favoreciendo la captación de pacientes”. Y, todo ello, promoviendo un marco colaborativo en el que trabajen de forma coordinada universidades y centros de investigación, la industria y los clínicos.
Los autores indican que también sería clave agilizar los tiempos de financiación pública, sobre todo en aquellos casos en los que los pacientes carecen de alternativas terapéuticas. Y mejorar la transparencia en procesos como el de la fijación de precios, así como procurar un acceso equitativo en todo el territorio nacional, no solo a tratamientos, sino también a procesos de diagnóstico o a atención asistencial y sociosanitaria, entre otros aspectos.
Se deben disminuir las barreras administrativas y legales de los ensayos clínicos, favoreciendo la captación de pacientes. Y sería clave agilizar los tiempos de financiación pública, según el proyecto Fineerr.
Por otra parte, recomiendan introducir fórmulas de financiación en las que Administración pública y los laboratorios comercializadores del tratamiento compartan los riesgos, con retornos de la inversión más ligados a la consecución de hitos y no tanto a las ventas.
En este sentido, sería muy útil la utilización de herramientas de digitalización y reevaluación dinámica de resultados clínicos y económicos.
“Se debe avanzar en un registro único o plataforma digital nacional con criterios bien definidos y unificados y con información estructurada que permita el uso del big data, a partir de una gobernanza previa adecuada. Para ello, se debe mejorar la gestión de la información y liberar a los profesionales sanitarios de esta tarea administrativa”, resume el texto.
Para finalizar, el documento llama a alcanzar un consenso político, un pacto a nivel nacional como marco donde encajar y coordinar todas las acciones que se lleven a cabo en este ámbito, que desemboque en una estrategia dotada de recursos y aplicada de forma oportuna y equitativa. Y sin discrepancias que terminen convirtiéndose en barreras que frenen nuevos logros.
Evolución de los tratamientos
Como explica el informe El valor del medicamento desde una perspectiva social, también elaborado por la Fundación Weber, esta vez con la colaboración de Farmaindustria, las enfermedades poco frecuentes se caracterizan por ser “dolencias crónicas y degenerativas que comprometen la vida de los pacientes”.
Como ya se ha comentado, tienen una prevalencia muy baja de forma individual, aunque en conjunto afectan a un 6,7% de la población de la Unión Europea.
Los medicamentos que se utilizan para tratarlas se denominan ‘huérfanos’, una etiqueta que permite al laboratorio que los desarrolla obtener financiación para su I+D, así como recibir apoyos específicos antes de que se le autorice la comercialización.
“Una vez que se completa el desarrollo, el producto puede beneficiarse de una autorización de comercialización, con periodos de exclusividad de mercado determinados: diez años de manera general en la UE o doce si son de uso pediátrico”, reza el documento de la Fundación Weber.
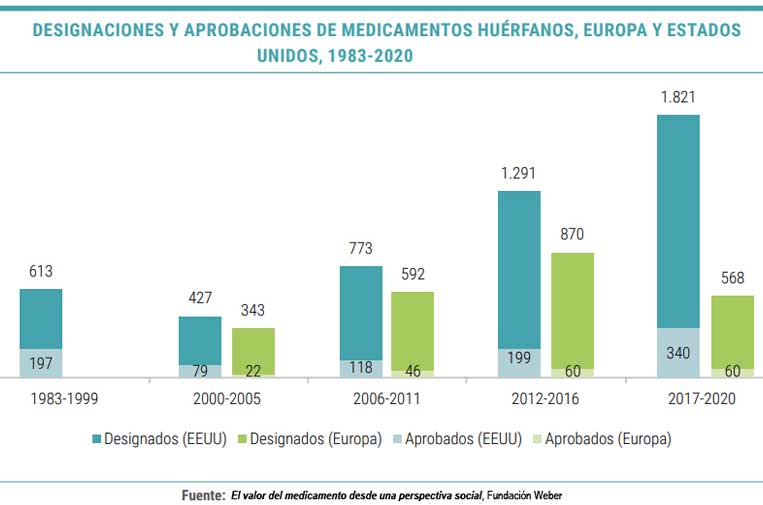
Desde que se aprobase la resolución CE 141/2000 relacionada con el tratamiento de enfermedades raras y hasta 2020, en Europa han sido designados como medicamentos huérfanos (MMHH) cerca de 2.400 fármacos, y han recibido la autorización de comercialización unos 190. El 70% de sus indicaciones estaban relacionados con el área de oncología, la mayoría dedicadas al linfoma No-Hodgkin, la leucemia mieloide aguda y el cáncer de páncreas.
No obstante, también han aparecido terapias novedosas, como el primer tratamiento para la esclerosis lateral amiotrófica (ELA) o para la enfermedad de Fabry, y nuevas opciones terapéuticas para la hipertensión pulmonar, la acromegalia, la enfermedad de Gaucher y la fibrosis quística.
También para tratar el angioedema hereditario, una afección genética fatal que afecta a los vasos sanguíneos y que es causada por el funcionamiento inadecuado de una proteína llamada inhibidor de C1.
Todas estas innovaciones han servido para introducir opciones terapéuticas para dolencias graves que no tenían un tratamiento específico, mejorando así la supervivencia y la calidad de vida de los pacientes.
Según datos incluidos en el informe de la Fundación Weber, cada MMHH que entra en el mercado es capaz de evitar unas quinientas muertes.
En el documento se menciona también el estudio Una evaluación del impacto económico y social de la regulación de medicamentos huérfanos, coordinado por Tim Wilsdon, que asegura que entre los años 2000 y 2017 han sido más de siete millones los pacientes europeos con enfermedades raras que han podido beneficiarse de estos fármacos. Sobre todo, porque les han concedido una mejora en su calidad de vida y una reducción de la carga sobre los cuidadores que les atienden.
A pesar de ese impacto positivo, siguen quedando muchos retos pendientes y muchos hitos que lograr para ir reduciendo poco a poco ese 95% de enfermedades poco frecuentes que todavía siguen sin tratamiento.
Hay muchas esperanzas puestas en la investigación de las terapias génicas, del ARNm y de otras técnicas de medicina personalizada que podrían ayudar a corregir los defectos de carácter genético que provocan estas dolencias. Fórmulas que ya están muy avanzadas y que en los próximos años seguramente nos darán muchas alegrías.